
Captor Therapeutics ®
Nauka
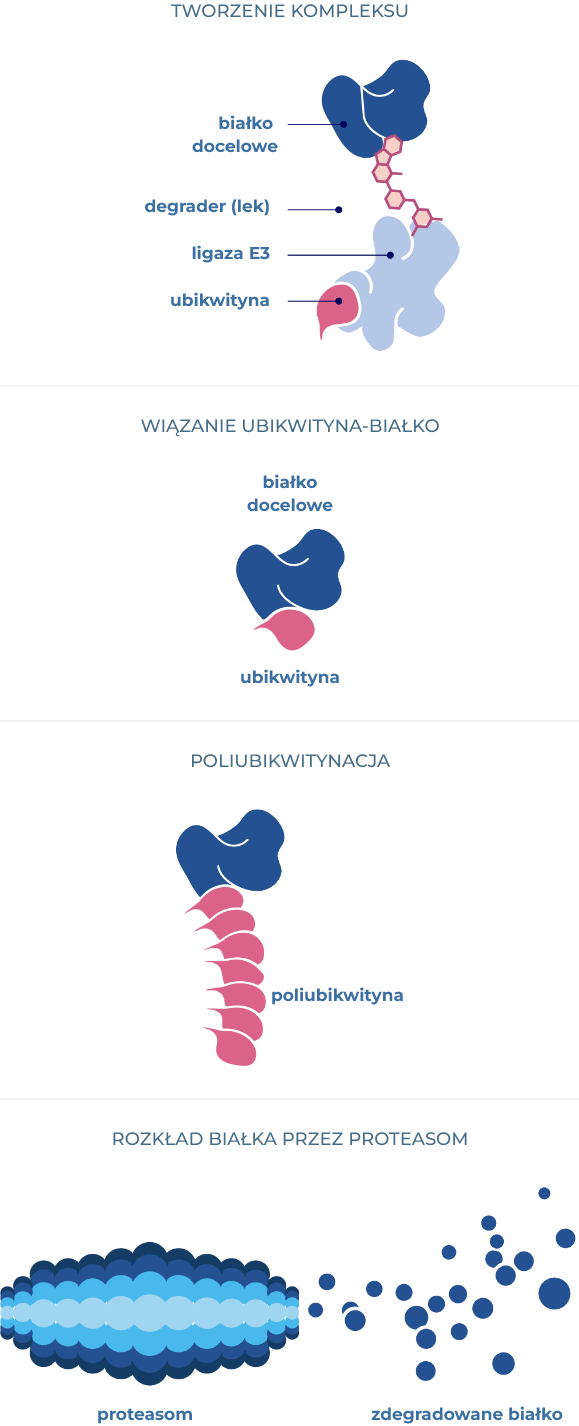
Celowana degradacja białek (TPD) polega na przyłączaniu cząsteczek ubikwityny do docelowego białka, oznaczając je do degradacji w proteasomie - systemie utylizacji odpadów w komórce.
Ubikwityna służy jako znacznik molekularny w tym procesie. Przyłączanie ubikwityny jest ułatwione przez kaskadę enzymów znanych jako ligazy ubikwitynowe.
Technologia TPD stosuje dwie główne klasy związków: bifunkcyjne degradery i kleje molekularne. Bifunkcyjne degradery wiążą się jednocześnie z białkiem docelowym i ligazą ubikwityny, ułatwiając ich oddziaływanie i prowadząc do ubikwitynacji, a następnie degradacji białka docelowego. Z drugiej strony kleje molekularne wiążą się wyłącznie z ligazą ubikwityny, zmieniając jej powierzchnię i umożliwiając nowe interakcje, które skutkują ubikwitynacją i degradacją wcześniej niedostępnych substratów.
Wykorzystując zasady TPD i stosując zarówno bifunkcyjne degradery, jak i kleje molekularne, Captor Therapeutics dąży do rozszerzenia możliwości terapeutycznych małych cząsteczek. Podejście to ma potencjał przezwyciężyć oporności na leki i umożliwia celowania w białka, które wcześniej stanowiły wyzwanie, otwierając w ten sposób nowe możliwości rozwoju innowacyjnych terapii szerokiej gamy chorób.
Korzyści
 Potencjał przezwyciężenia oporności na tradycyjne leki
Potencjał przezwyciężenia oporności na tradycyjne leki
 Katalityczny mechanizm działania
Katalityczny mechanizm działania
 Potencjał uderzania w nieosiągalne do tej pory cele białkowe
Potencjał uderzania w nieosiągalne do tej pory cele białkowe
Platforma Optigradeᵀᴹ to niezwykle efektywne narzędzie służące do odkrywania i rozwoju kandydatów na leki.
Platforma Optigrade, bazująca na wykorzystaniu odkryć ostatniego dziesięciolecia w obszarze celowanej degradacji białek (TPD), została zaprojektowana w celu efektywnego dostarczania kandydatów na leki, o optymalnych właściwościach farmakologicznych, uderzających w cele molekularne o wysokim potencjale terapeutycznym.
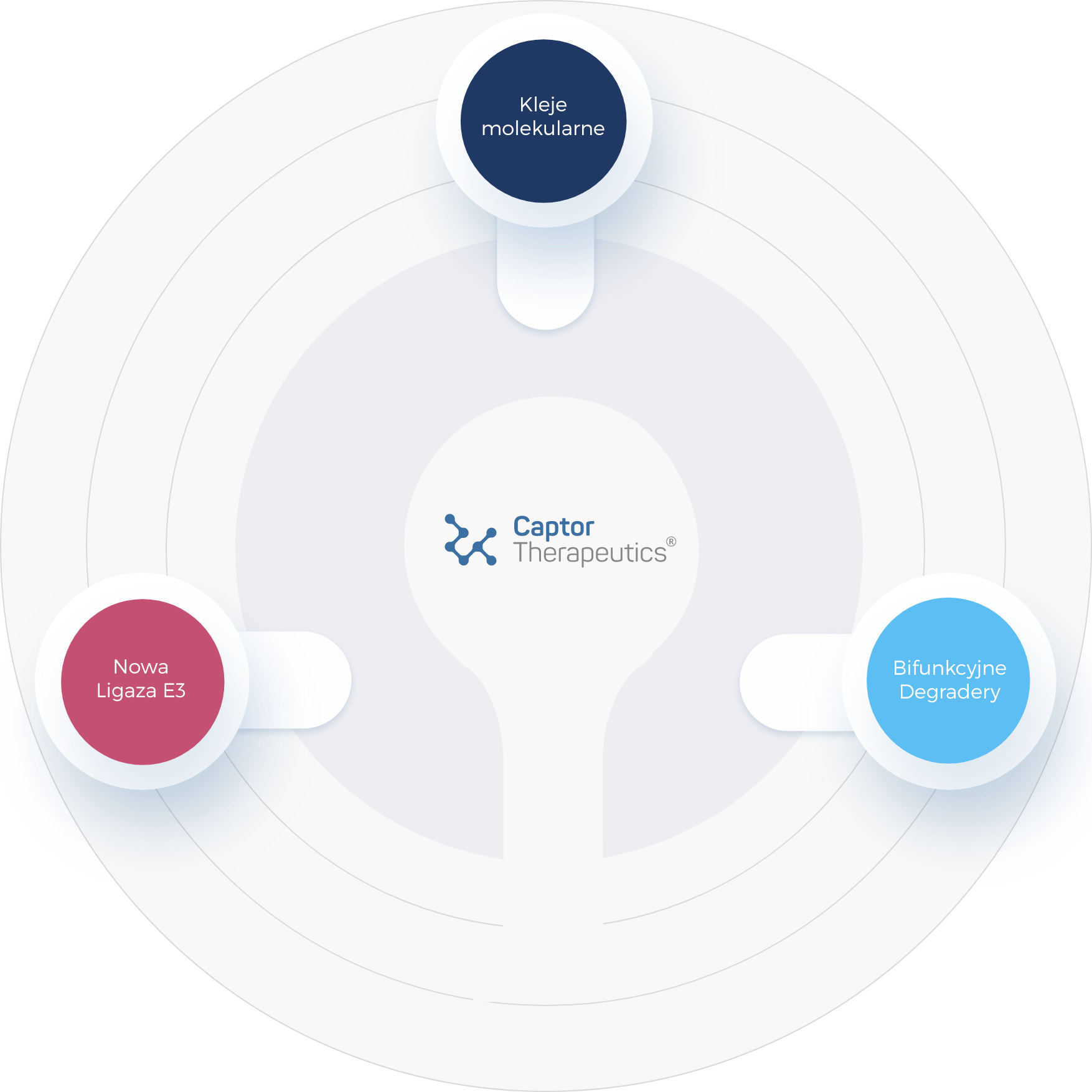
Strategia firmy Captor Therpeutics w obszarze celowanej degradacji białek koncentruje się na trzech kluczowych elementach: bifunkcyjnych degraderach, klejach molekularnych oraz ligazach E3 ubikwityny, zwłaszcza nowych ligazach, które mogą być bardziej efektywne w degradacji białek niż dotychczas poznane ligazy E3.
Firma Captor opracowała obszerną bibliotekę degraderów i klejów molekularnych oraz stworzyła platformę integrująca kompetencje w zakresie inżynierii białek i biologii strukturalnej, która z powodzeniem dostarczyła dziesiątki nowych ligaz E3.
Zróżnicowanie platformy
- Związki wiodące zarówno w puli klejów molekularnych, jak i bifunkcyjnych degraderów
- Oparte na strukturze wyszukiwanie cząsteczek aktywnych i optymalizacja związków wiodących
- Nowa, autorska chemia
- Degradery o wysokim potencjalne klinicznym (potencjał koniugatów przeciwciał - ADC)
Rozwijająca się Platforma LiLis™
Degradery nowej generacji wykorzystujące nowe ligazy E3- Biblioteka ligaz E3 i ich ligandów
- Potencjalna poprawa bezpieczeństwa
- Tkankowo-specyficzna ekspresja
Kleje molekularne
Małe cząsteczki z optymalnymi właściwościami farmakologicznymi, które stabilizują oddziaływanie ligazy E3 z białkiem docelowym- Racjonalny schemat badań przesiewowych dla nowych celów terapeutycznych
- Biblioteka autorskich klejów molekularnych na bazie CRBN
- Selektywna degradacja i nowe profile skuteczności
Bifunkcyjne Degradery
Modułowe podejście do odkrywania degraderów- Wiele degraderów opartych na CRBN degraduje zarówno Ikaros, jak i Aiolos, co przekłada się na efekty uboczne
- Opracowane przez Captor ligandy CRBN cechują się lepszym profilem selektywności
- W tym degradery przeciwko celom nie dającym się dotychczas degradować

.png)
.png)